Metastasi tumorali: ricerca apre a nuovi farmaci
Svelata la struttura tridimensionale di LH3, un enzima umano coinvolto nella modifica del collagene, la più abbondante proteina del nostro corpo che sostiene cellule e tessuti per formare gli organi. LH3 è un enzima indispensabile per la corretta maturazione del collagene e fa parte di una famiglia di enzimi chiamate LH (lisil idrossilasi).
Il nuovo studio, pubblicato sulla rivista Nature Communications, riporta per la prima volta la struttura tridimensionale a livello atomico di LH3 ottenuta per mezzo della cristallografia a raggi X.
Collagene, enzima LH3, tumori: cosa succede
La struttura molecolare di LH3 rivela come due copie dell’enzima lavorino simultaneamente in una geometria allungata piuttosto atipica e per questo fino a ieri molto difficile da comprendere senza il modello tridimensionale accurato che è
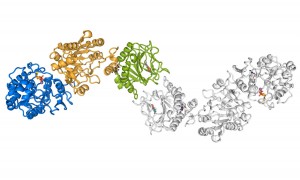
emerso dagli esperimenti. E non è tutto: LH3 è un enzima multifunzionale, ossia svolge più attività enzimatiche, una caratteristica questa molto peculiare e che capita di osservare molto raramente. Anche in questo caso, il dato strutturale rappresenta un elemento fondamentale per capire il corretto funzionamento di questo complesso enzima.
Mutazioni nei geni che codificano queste proteine causano gravissime malattie genetiche rare delle ossa e del tessuto connettivo tra cui diverse tipologie di osteogenesi imperfetta, la sindrome di Elhers-Danlos e la sindrome di Bruck.
Studi recenti associano inoltre malfunzionamenti degli enzimi LH alla progressione e formazione di metastasi in diversi tipi di tumori solidi: attorno alle cellule tumorali infatti spesso si formano vere e proprie “autostrade di collagene” che promuovono la migrazione di cellule tumorali in altri tessuti.
Possibili nuovi farmaci
Questo importante traguardo rappresenta un nuovo punto di partenza. Il team è adesso pronto ad estendere le strategie sviluppate per studiare LH3 e gli altri enzimi della famiglia delle lisil idrossilasi, con particolare attenzione ai loro malfunzionamenti causa di progressione metastatica di alcuni tipi di molti tumori solidi.
“Il progetto si è rivelato una sfida fin dall’inizio ed è stato un percorso non privo di ostacoli, ma la perseveranza e il lavoro di squadra hanno dato i loro frutti” dice Luigi Scietti, prima firma dell’articolo. “La nostra scoperta costituisce una spinta notevole per lo sviluppo futuro di farmaci capaci di prevenire la formazione di metastasi“.
La ricerca è stata condotta nel laboratorio di Biologia Strutturale Armenise-Harvard dell’Università di Pavia, Dipartimento di Biologia e Biotecnologie “Lazzaro Spallanzani” sotto la guida dal Prof. Federico Forneris, Lo studio ha utilizzato tecniche di biologia molecolare, biologia strutturale e biochimica, a disposizione del laboratorio pavese, grazie al fondamentale sostegno della Fondazione Armenise-Harvard, di Fondazione Cariplo e di AIRC (Associazione Italiana per la Ricerca sul Cancro).


