Antibiotici più efficienti: ecco come “entrare” nei batteri
È stato spiegato il meccanismo molecolare con cui aggirare l’antibiotico-resistenza dello Pseudomonas aeuroginosa, uno dei quattro batteri più pericolosi del mondo, secondo la classifica dell’Organizzazione Mondiale della Sanità (Oms). Il lavoro, pubblicato su Nature Communications, è frutto di una collaborazione internazionale tra l’Istituto officina dei materiali del Consiglio nazionale delle ricerche (Cnr-Iom), le università di Cagliari e di Oxford e il Centre national de la recherche scientifique (Cnrs).
Antibiotico-resistenza: uccide 700mila persone l’anno
L’antibiotico resistenza, che secondo l’Oms uccide 700mila persone l’anno, è un problema rilevante per le case farmaceutiche, che faticano a sintetizzare nuovi prodotti. Gli antibiotici già esistenti non funzionano più, perché i batteri hanno imparato a riconoscerli e per sconfiggerli bisognerebbe usare dosi tossiche per l’uomo. Il consorzio pubblico di ricercatori scienziati dell’Imi, un’iniziativa dell’Ue che si occupa di medicina innovativa, ha avviato una ricerca nell’ambito di un più ampio progetto europeo per affiancare le case farmaceutiche nella soluzione di problemi di questo genere.
Penetrare la membrana esterna dei batteri
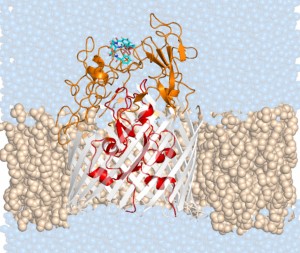
“La difficoltà non è identificare le molecole capaci di uccidere i batteri, quanto quella di renderle capaci di raggiungerli, penetrandone la membrana esterna, un problema che risulta evidente quando si passa dagli esperimenti in laboratorio a quelli in vivo. La membrana di alcuni batteri è particolarmente spessa e affinché l’antibiotico raggiunga il batterio è necessario trovare dei varchi”, spiega Matteo Ceccarelli, del Cnr-Iom.
Una possibile via di ingresso è stata svelata nei suoi aspetti molecolari dal nuovo studio. “Si immagini la spessa membrana che protegge il batterio come un muro con una serie di porte e finestre: sono chiuse, ma esiste una chiave per aprirle. In questo caso la porta è un recettore dal nome PfeA e la chiave si chiama Enterobactin”, prosegue Ceccarelli. “Il recettore PfeA è una proteina di membrana che si trova sullo strato più esterno del batterio e che ha il compito di lasciar passare le molecole che trasportano il ferro all’interno”, spiega Ceccarelli. “La chiave di questa serratura per aprire la porta che fa passare il ferro, nel caso di PfeA, si chiama Enterobactin. Il trucco sta nel legare a questa molecola non solo il ferro ma anche il nostro antibiotico, cosicché i recettori PfeA vengano ingannati e lascino passare anche il framaco attraverso la membrana”.
Aggirato lo Pseudomonas aeuroginosa, ma non solo
La potenziale via di accesso per far penetrare gli antibiotici è stata studiata in Pseudomonas aeuroginosa uno dei quattro batteri considerati dall’Oms i più pericolosi del mondo, responsabile di molte gravi infezioni fra le quali la polmonite nei pazienti affetti da fibrosi cistica.
“Il recettore PfeA identificato in questa ricerca è tipico del batterio Pseudomonas aeuroginosa, ma se ne possono trovare di molto simili in altri batteri: Escherichia coli, per esempio, ne ha uno (FepA) che funziona nella stessa maniera”, conclude il ricercatore Cnr-Iom.
Ogni partner della ricerca ha avuto un ruolo differente: l’università di Oxford si è occupato della produzione e cristallizzazione del recettore, il Cnrs di Strasburgo ha sintetizzato la molecola Eterobactin, Cnr-Iom con l’università di Cagliari si sono occupati di studiare e modellizzare l’interazione tra Enterobactin e il recettore PfeA.


